2022年,是全球首位被CAR-T细胞免疫疗法治愈的白血病儿童——Emily Whitehead,实现无癌生存的第10年。
2012年,患上急性淋巴细胞白血病(B-Cell Acute Lymphoblastic Leukemia)的Emily ,在病情二次复发且无药可以治疗的情况下,参与了费城医院启动的一项针对儿童B细胞急性淋巴细胞白血病的CAR-T临床试验。通过靶向CD19的CAR-T治疗,三周后,Emily的癌细胞完全消失。10年过去,依然没有复发。

Emily照片
(图源:公开信息,侵删)
出现在Emily身上的肿瘤治愈“奇迹”,激励了无数科研、产业界的精英人士对CAR-T细胞免疫疗法的深入探索,且在近几年陆续有相关产品获批——美国FDA已批准的CAR-T产品有6款,欧盟批准的CAR-T产品有3款,国内目前也有2款CAR-T产品获批。
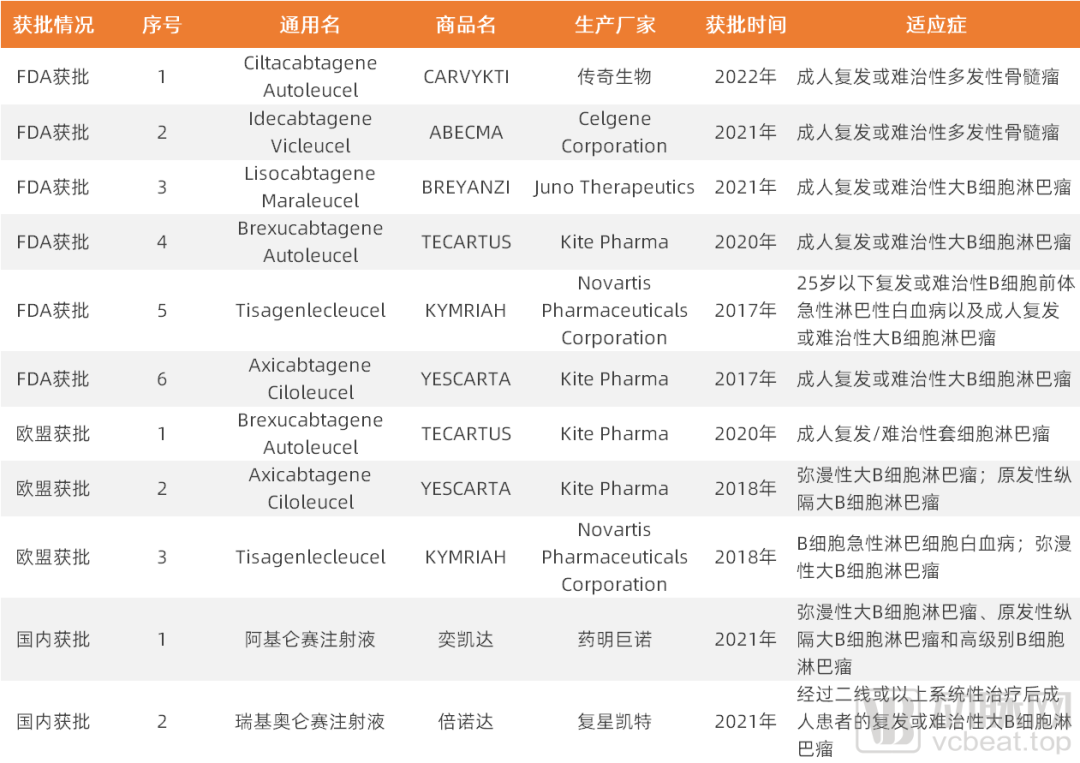
全球CAR-T产品目前获批情况
(经公开信息整理,动脉网制图)
Emily的“奇迹”是细胞治疗产品中一个非常典型的案例,但其实,还有包括DC产品在内的其他免疫细胞治疗产品以及包括造血干细胞(HSC)、间充质干细胞(MSC)等在内的干细胞产品,在不同患者身上上演着类似Emily的“奇迹”。
近日,顶尖学术期刊《Nature》发表了一项关于CAR-T细胞治疗白血病的长期潜力和稳定性的研究报告。由全球知名CAR-T 之父Carl June教授领衔的团队通过长期研究发现,在两位慢性淋巴细胞白血病患者的身上,经过十年,仍然可以检测到活跃的CAR-T细胞,虽然数量低,但可测量,并且保留了杀伤力,使得患者的病情得到了持续的缓解。

这些奇迹背后交织的希望与感动,促成了全球细胞治疗赛道火热发展的大势——欧美目前共计已经批准数十款细胞治疗相关产品。再看国内,随着去年2款细胞治疗产品——复星凯特的奕凯达(阿基仑赛注射液)与药明巨诺的倍诺达(瑞基奥仑赛注射液)相继获批,今年传奇生物/强生的BCMA CAR-T疗法产品西达基奥仑赛(cilta-cel,商品名为Carvykti)的成功“出海”,大为提振了国内产业界和市场对于细胞治疗行业发展的信心,也使得他们对于细胞治疗赛道的热情再上一层。
无数的企业铆足劲头,积极推进自身细胞产品的研发;无数的资本纷纷散金,押注在自家看好的细胞治疗初创企业身上。
形成的局面是,目前中国细胞治疗临床试验数量处于全球领先地位,仅次于美国;仅2020年,国内细胞疗法领域融资总金额达到126亿人民币,2016-2020年细胞疗法领域的融资金额复合增长率达到118.8%。
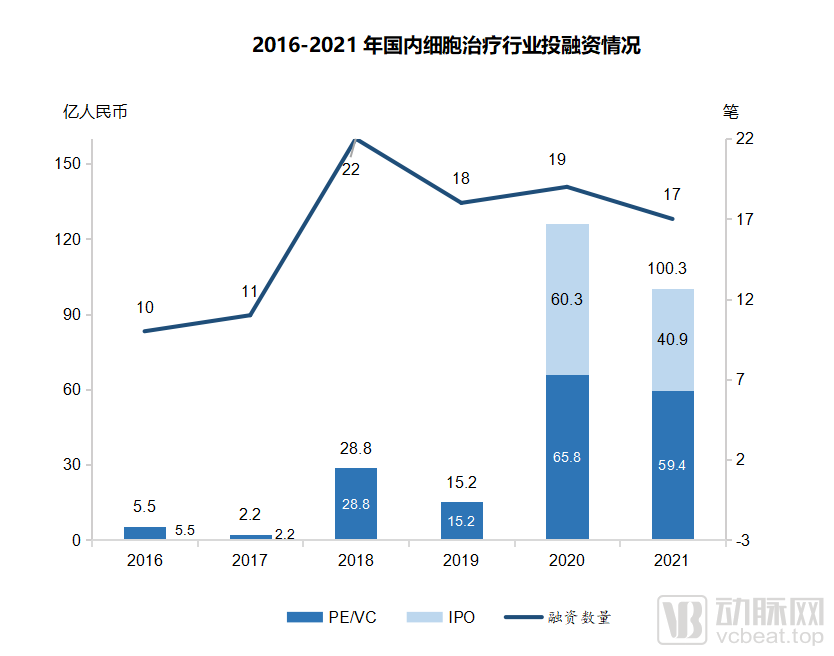
2016-2021年国内细胞治疗行业投融资情况
(图源:Frost & Sullivan报告)
整个细胞基因治疗行业开始大规模进入产业化阶段。而产品开发的成功率和速度,则成为企业制胜的关键。
细胞药的产业化验证和药学工艺开发是困扰当前创新药公司推进细胞药产业化的“限速步骤”。因此,关于CDMO如何助力细胞治疗产业化进程,成为业界关注的焦点——细胞治疗赛道的火热发展,直接催生了细胞治疗CDMO行业“春天”的到来。
细胞治疗行业对于CDMO需求更加强烈
细胞治疗CDMO的职能,主要是为细胞治疗企业提供临床新药的工艺开发和制备,以及已上市药物工艺优化和规模化生产服务,包括临床前和临床试验研究用药的生产以及商业化药品生产。
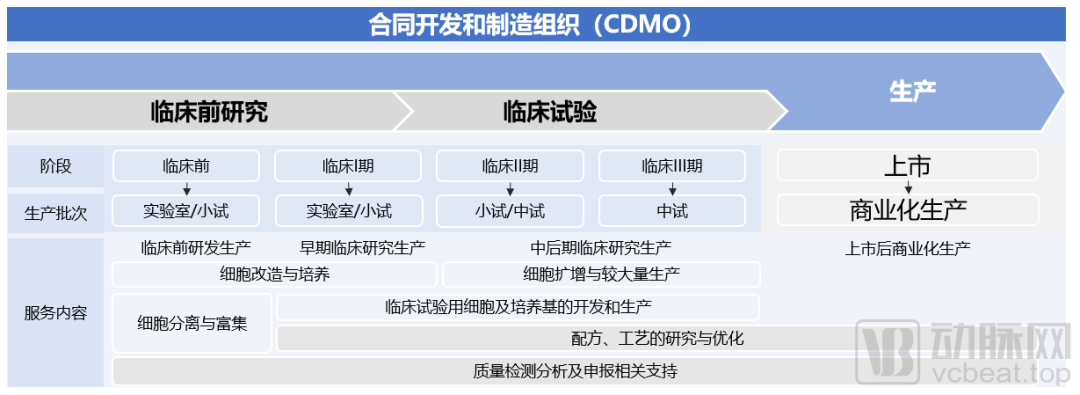
CDMO服务内容概览
(图源:Frost & Sullivan报告)
其在行业中起到的作用,包括降低企业早期研发细胞治疗药物的生产风险以及成本、缩短企业研发周期、满足监管机构对于企业在产品质量、安全上的合规要求等,与传统药物领域在CDMO方面的应用需求场景类似。
但不同的是,细胞治疗行业对于CDMO的需求和意愿更加强烈。
背后的原因主要体现在三方面:
1、作为一个新兴赛道,相关企业以初创公司为主,很多公司倾向于将资金用在管线开发、团队建设等方面;
2、相比传统药物研发,细胞治疗药物需要的研发投入更高;
3、细胞治疗药物的生产工艺复杂、门槛更高。
作为一个新兴赛道,细胞治疗行业的相关企业以生物技术初创公司为主,体量较大的传统药企属于少数。而初创企业往往在资金、人才以及其他资源方面实力不够雄厚,却面临自有产能建设资金成本高、建设速度慢、验证时间长、需要大量生产、QC等人员等方面难题。因此,与其他传统药物领域在CDMO方面的需求相比,细胞治疗赛道对于CDMO的需求更加旺盛和迫切。
根据Frost & Sullivan的报告,细胞/基因疗法在发现和临床前阶段的研发费用在9亿美元至11亿美元,临床阶段的费用在8亿美元至12亿美元;细胞治疗药物开发的高投入,使得细胞治疗企业对于利用专业的外包研发生产团队来降低药物开发成本的需求很高。
关于细胞治疗药物的成本问题,星奕昂生物创始人、前复星凯特CEO王立群曾公开表示,由于细胞治疗药物的CMC一旦改动,就是“完全不同的产品”,而产品一旦完成申报就没有太多降低成本的空间。因此,细胞药物产品的成本降低应该从开始立项的时候考虑。 “可以把第一个产品的经验,通过创新用到第二、第三个产品开发。”王立群说道。
然而,由于多数企业在细胞药物的开发上缺乏经验,而首款产品的成功与否又极为关键,这时,具备成熟细胞治疗基础研究能力与开发改造经验的专业细胞治疗CDMO,为药企提供了另一个更加稳妥的选择。通过提供全方位的解决方案,CDMO能够帮助企业提高研发效率并控制风险,最终实现细胞产品的商业化。
另外,由于细胞治疗药物面临规模化生产难度大、工艺优化技术壁垒高等研发挑战,导致该领域企业对于CDMO服务需求更加强烈。相比传统大分子、小分子药物,细胞药物有更高的研发生产要求:不仅需要构建细胞库、病毒载体选择及优化,细胞规模化放大培养,对质量检测、批间稳定性、制剂及运输、用药也都有更加严格的要求。
细胞治疗CDMO公司通常拥有大型细胞或载体库,可以帮助药企选择适合的细胞或载体,并进行工艺优化,从而减少试错成本,提高研发效率和成功率;其丰富的生产平台和严格的质检措施可以帮助药企削减商业化生产成本和时间——专业的QA/QC人员和全过程的严格监管,会确保细胞治疗产品的生产符合国家GMP质量标准。此外,一些细胞治疗CDMO公司能够提供一站式新药临床试验申请(IND)和新药上市申请(NDA)等法规相关服务,进一步帮助药企加快研发进度。
总的来说,细胞治疗CDMO可以“多、快、好、省”地完成目标产物的标准化生产,同时满足药企客户的定制化需求,帮助药企完成细胞药物的申报并实现稳定供应。
不过,以上我们所提到的细胞治疗CDMO的诸多优点,俱是在细胞治疗CDMO非常成熟专业这个前提下才能成立。如果一家细胞治疗CDMO不够成熟专业,那么药企在将自家的细胞药物交托到CDMO手中必定会存在诸多担心和疑虑。那么,国内细胞治疗CDMO赛道发展究竟如何?在遍布“掘金”队伍的细胞治疗产业,会率先冲出“卖水”队伍的哪匹黑马?
国内细胞治疗CDMO产业尚处于发展早期,极少数企业能提供成熟服务
动脉网此前做过关于基因细胞治疗CDMO领域的相关盘点,发现国内专门开展细胞治疗CDMO服务的企业很少,大部分CDMO企业会同时开展基因与细胞治疗CDMO服务。谱新生物可能是国内唯一一家专注于开展细胞治疗CDMO整体解决方案的提供商,该公司于近期刚刚完成近亿元的Pre-A轮融资,由普华资本领投。
细胞治疗作为医疗领域的新兴发展赛道,初创企业选择押宝在这样一个细分领域无疑需要一定的实力和勇气,因为风险实在是不小。为更深入了解这样一家选择走“少数企业才走的路”——专注在细胞治疗CDMO细分赛道的企业,我们与谱新生物首席执行官朱逸博士进行了对话。
为什么会选择专注开展细胞治疗CDMO服务?朱逸博士表示,做出这样的选择完全是基于公司团队自身的实力和优势——谱新生物团队早期研发过相关细胞治疗产品,积累了细胞药物研发生产方面的诸多经验。基于自身对细胞药的理解和开发能力,谱新生物能够帮助客户避开细胞药物研发生产中可能遇到的“坑”并顺利解决过程中可能遇到的很多难题,从而帮助客户“少走弯路”。
“与抗体和小分子领域的CDMO服务相比,细胞药CDMO服务有其独特性,工艺与生产标准差异巨大。因此对细胞药CDMO公司除了常规的cGMP、产能、质量等要求之外,还提出了更高、更新、更重要的要求——对于细胞药的深刻理解和产业端转化能力。”朱逸博士表示,从做药的角度来审视CDMO服务是一个很有挑战性的问题,尤其对于细胞药物来说,它的研发和生产是紧密联系的。
细胞治疗领域领头羊诺华在细胞药物的生产上多次选择与Oxford Biomedica (OXB) 进行合作,就是一个很好的明证。Oxford Biomedica成立于1995年,于2001年上市,被称为慢病毒载体基因治疗领域的先驱,拥有专利技术LentiVector基因递送平台,并基于此开发了多款基因疗法产品,同时对外提供基因与细胞治疗CDMO服务。由于看中Oxford在研发生产基因疗法产品方面的独特经验,自2013年至今,诺华一直与Oxford进行密切合作,屡次选择Oxford为公司的CAR-T候选产品提供慢病毒载体临床供应服务。

诺华与Oxford Biomedica进行了多次战略合作
(经公开资料整理,动脉网制图)
同样,以药物开发标准进行订单交付的谱新生物,会在及时发现问题的基础上,为客户提供确实可行的整改方案,甚至是在产品设计层面上的。“这对我们团队提出了很高的要求,但却大大减少了产品在后续开发过程中的障碍。保证每一阶段速度的同时保证产品开发的成功率,是谱新服务能给到客户的附加值。我们认为,这样的服务对客户来讲非常有价值。”
谱新生物第一项承接的注册临床生产项目是一款Phase I/II CAR-T细胞药项目。基于此细胞药早期研发,IND申报,注册临床生产等的全流程经验,谱新生物建立了完善的、立体化的、成熟的全流程服务能力。
国内细胞药CDMO公司的现状,是大部分公司仍处于在摸着石头过河、与客户共成长的过程中,很少有公司拥有成熟细胞药项目的交付经验。谱新生物是国内极少数拥有承接该类项目实际经验及能力的CDMO公司,这是其能够在众多龙头、初创企业布局细胞治疗业务的情况下仍然在行业内发展不错的重要原因。
作为国内最早布局细胞药物CDMO服务的公司之一,谱新生物的产业端客户数目已经超过100家。公司于2020年底独立运营,2021年全年收获订单1.2亿人民币。2021年8月,谱新生物与普米斯生物技术公司就细胞治疗药物委托开发生产达成全面战略合作,凭借其工艺开发能力和细胞药物GMP生产能力,为普米斯的多个新型CAR-T细胞药提供CDMO服务。
“客户对谱新的信任,是对我们能力最好的佐证。”朱逸博士高兴地说道。
GMP细胞治疗产品更严新文件发布,对以高标准建设厂房的企业是种利好
聚焦于细胞药物领域,谱新生物搭建了在行业独树一帜的创新平台——包括HiLenti™慢病毒平台及HiCellx™细胞技术平台等,是基于MAH制度下第一个细胞治疗药物生产的CDMO厂商产业化转化评估与服务平台。谱新生物拥有多个质粒工艺开发及中试生产的经验,掌握了安全可放大悬浮无血清细胞以及一次性反应器慢病毒生产工艺,已支持多个合作伙伴成功孵化了多款CAR-T、TCR-T、干细胞等药物。
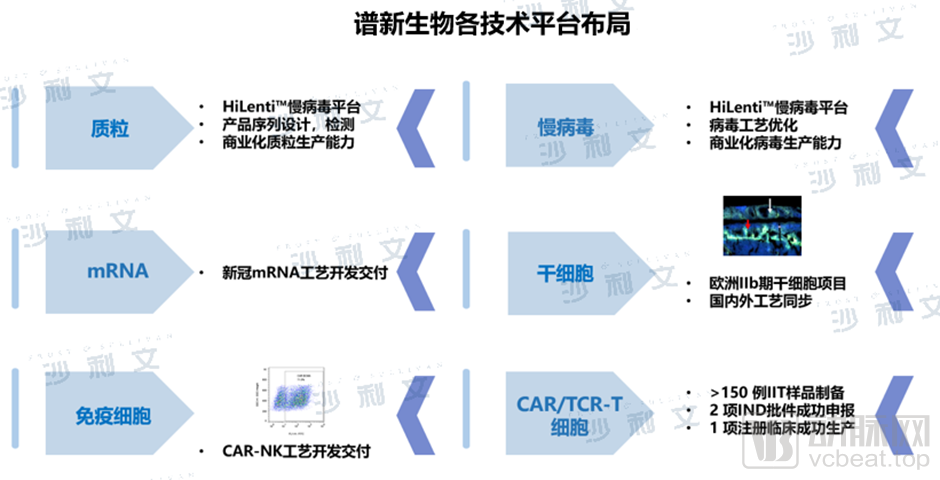
谱新生物各技术平台布局
(图源:Frost & Sullivan)
“谱新生物是国内率先实现无血清悬浮培养工艺的公司,也是目前少数有项目使用悬浮无血清慢病毒工艺并获得了IND默示许可的CDMO公司。”朱逸博士表示,随着细胞药行业进入产业化后期,对于病毒载体的产量、质量和稳定性提出了更高的要求。从技术角度来讲,病毒贴壁细胞制备的产能对于小规模研究使用已经足够,但对商业化生产来说,悬浮培养体系可以提供更高的产量与质量。
谱新生物HiCellx™细胞技术平台配备了所有国际上卫生监管部门普遍认可的封闭细胞生产设备,同时具备成熟的封闭细胞生产平台工艺,已支持进行多个项目的细胞生产。“要根本解决生产稳定性的问题,前提是减少人为的干预,更多采用自动化全封闭式的培养体系进行产品生产,这是细胞治疗行业未来的发展趋势。”朱逸博士说道。
在产能建设方面,谱新生物目前在苏州总部拥有10000平米GMP厂房,在深圳基地有8000平米GMP厂房在建,已经初步形成全国布局的生产基地网络。另外,美国北卡基地也正在建设当中,以同步进行公司在全球的产能布局。“谱新生物目前拥有与细胞药产品上市企业同级别的生产能力和质量体系,一切生产设施、整体建设标准均是为未来细胞与基因治疗商业化生产而建立。”
2022年1月6日,国家药监局综合司公开征求《药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》意见,是GMP细胞治疗产品附录的第二版征求意见稿。此次文件考虑了细胞产品这种特殊的药品在生产管理过程中存在的实际情况,同时也提出了更高的管理要求,对涉及各方面安全性的内容要求更加严格。
“文件提升了行业的准入门槛,对生产管理提出了更高的要求。我们谱新生物所有厂房的建设都是按照中国监管机构对于细胞药物的高监管标准进行,国内标准在有些细节方面甚至超过了美国FDA的监管标准。因此,药监局这项文件的落地对公司来讲是一种利好,谱新生物始终以做药的角度考虑来看待发展过程中需要考虑的各类问题。”
“让细胞药物谱写生命新篇章”,是谱新人的愿景。基于自身的团队能力,将专注的优势发挥到极致,是他们行事的风格。在细胞治疗CDMO这条看似挺小的细分赛道,有着谱新人不小的梦想。
转载自:动脉网
原新闻链接:遍布“掘金”队伍的细胞治疗产业,将率先冲出“卖水”队伍的是哪匹黑马?

Building 4, Yuewang Wisdom Valley, 1463 Wuzhong Avenue, Wuzhong District, Suzhou, China